Mucho, poco, tantito… son adjetivos cualitativos que en nuestro día a día y conocido el contexto, o sea la referencia con respecto a la cual comparamos, suelen ser suficientes para describir cantidades. Sin embargo, en ciencia cuantificar es importante. Pero, ¿cómo cuantificar de manera que todos entendamos si esas cantidades son grandes o pequeñas, si representan mucho o poco? Para ello es imprescindible utilizar unidades de medida y que nos pongamos de acuerdo en esas unidades. Por ejemplo: si decimos que un coche iba por la autopista a 220 km/h todos sabemos que iba muy rápido porque estamos familiarizados con esta unidad para referirnos a la velocidad a la que se mueven los coches. Por el contrario, si alguien nos dijera que un coche iba por la autopista a 1500 pie/minuto, probablemente no tendríamos idea de si el coche iba rápido o lento. En realidad, esto equivale a 27.4 km/h. Hecha la conversión, es fácil imaginar que había mucho tráfico en la carretera o que por alguna razón el conductor iba muy despacio.
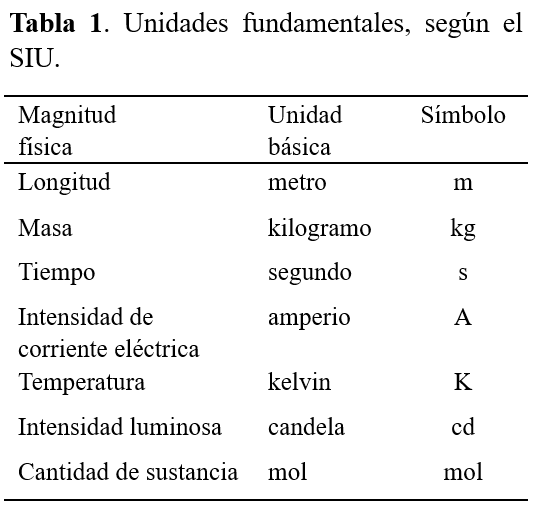
Para unificar el lenguaje de las mediciones en ciencias existe el Sistema Internacional de Unidades (SIU) que fue creado en 1960 por la Conferencia General de Pesos y Medidas. Inicialmente el SIU definió seis unidades físicas básicas o fundamentales (Tabla 1). No fue hasta 1971 que se incluyó la séptima: el mol, la unidad que hoy nos ocupa y que es la más directamente relacionada con la química. Entonces, como químicos, es crucial que entendamos este concepto.
Empecemos por la definición rigurosa. El mol es la unidad de cantidad de materia de un sistema que contiene tantas entidades elementales como átomos hay en 0.012 kilogramos de carbono 12. O dicho de otro modo, un mol es la cantidad de materia de un sistema que contiene 6.02 × 1023 entidades elementales, porque en 0.012 kilogramos de carbono 12 hay 6.02 × 1023 átomos de carbono. ¿Todavía no muy claro?
Expliquemos un poco más. Ante todo, cuando se usa el término mol debe especificarse el tipo de partículas elementales a las que nos referimos. Estas pueden ser átomos, moléculas, iones, electrones, otras partículas o grupos específicos de estas partículas, o cualquier otra cosa para la que queramos expresar sus cantidades en moles (digamos, por ejemplo, zapatos, músicos, huevos, personas, cabezas, dedos). Y aquí la palabra cantidad es la clave. Si se menciona un par de zapatos, todos entendemos que son dos zapatos (la palabra par representa la cantidad 2). De igual modo sabemos que un trío de músicos está formado por tres de ellos (la palabra trío representa la cantidad 3) y que una docena de huevos contiene doce huevos (la palabra docena representa la cantidad 12). Pues así mismo la palabra mol representa la cantidad 6.02 × 1023. Aunque este sea un número mucho mayor que 2, 3 o 12, la lógica es idéntica. Tenemos una palabra que representa una cantidad.
Pero, ¿qué había descubierto Avogadro? Pues que volúmenes iguales de gases diferentes, en las mismas condiciones de presión y temperatura, contienen el mismo número de moléculas (Hipótesis de Avogadro, o Ley de Avogadro, 1811). La mayor dificultad que tuvo que enfrentar con su ley se relacionaba con la confusión existente en aquella época entre átomos y moléculas. De hecho, una de sus contribuciones más importantes fue clarificar la distinción entre ambos conceptos.
La ciencia avanza paso a paso y a menudo un gran descubrimiento es solo posible gracias a múltiples contribuciones. ¿Quién sabe?, es posible que sean necesarias hasta un mol de pequeñas contribuciones para realizar un gran descubrimiento.




